Autores: Dr. Redmond Burke, jefe de Cirugía Cardiovascular, y Dr. Anthony Rossi, jefe de Medicina Cardiovascular.
Introducción:
El Instituto del Corazón de Nicklaus Children’s Hospital permanece enfocado en brindar la mejor y más segura experiencia para pacientes que se someten a una cirugía congénita del corazón. En este informe, se repasarán los 24 años de experiencia quirúrgica del programa en el tratamiento de niños con un diagnóstico de TOF (tetralogía de Fallot).
Métodos:
Revisamos nuestra base de datos de CardioAccess a fin de identificar a los pacientes que se sometieron a una reparación de TOF desde septiembre de 1995 hasta febrero de 2019. Los pacientes incluían a quienes tenían defectos del canal AV (auriculoventricular) y a quienes tenían TOF y la ausencia de la válvula pulmonar. Los pacientes con TOF/atresia pulmonar no fueron incluidos en este informe.
La imagen digital de la cirugía correspondiente al procedimiento de cada paciente se usó de forma rutinaria para documentar la anatomía y reparación de cada lesión. Se grabaron todas las cirugías con una cámara ubicada en el cabecero de la mesa de operaciones. El video era visible para todo el equipo durante el procedimiento y se almacenó de forma digital para una revisión de desempeño a pedido. Los enfermeros quirúrgicos profesionales toman imágenes diarias de los pacientes en la cabecera con cámaras digitales. Estas imágenes se almacenan cronológicamente en el EMR (registro médico electrónico) a modo de documentación visual de las afecciones preoperatorias de cada paciente y de su recuperación posoperatoria.
Éxitos de la cirugía clínica, Redmond Burke 2019:
La reparación de TOF en lactantes se realiza con una canulación bicava a través de la orejuela derecha y la unión auricular/IVC (vena cava inferior), y se coloca una cánula de ventilación en la aurícula izquierda. Las arterias pulmonares se controlan con torniquetes. El RV (ventrículo derecho) se inspecciona para confirmar la anatomía coronaria. Se colocan dos suturas de anclaje de polipropileno 6-0 en el infundíbulo, y se usa una hoja n.° 11 para entrar en la cavidad ventricular derecha. La incisión nunca es de más de la mitad de largo que el RVOT (tracto de salida del ventrículo derecho). Los paquetes musculares se extirpan con una tijera para tenotomía, y la incisión se extiende hasta unos milímetros del anillo de la válvula pulmonar. Los paquetes musculares parietales se visualizan al colocar al paciente en posición de Trendelenburg e inclinar la mesa hacia el cirujano. Se inspecciona el VSD (defecto septal interventricular) y se corta el parche de pericardio nativo tratado con glutaraldehído para darle la forma correcta. Se usa una sutura de polipropileno 7-0 continua para sujetar el parche al VSD, utilizando pequeñas porciones de tejido del endocardio, comenzando en cada brazo en los músculos papilares del cono y cosiendo en dirección al cirujano, permaneciendo a 2 mm del anillo de la válvula aórtica. No se utilizan suturas con parches o de puntos separados. La válvula pulmonar se inspecciona y se mide su tamaño con dilatadores de Hegar. Las comisuras fusionadas se separan con una hoja n.° 11. La preservación de la válvula pulmonar es una prioridad, pero no a expensas de que se produzca presión en el RV superior a la presión sistémica media. Si la válvula pulmonar es demasiado pequeña, se hace una incisión transanular en la bifurcación de las arterias pulmonares, y esta incisión se cierra con un solo parche pericárdico y polipropileno 6-0 continuo. No creamos valvas ni monocúspides pulmonares artificiales.
Las reparaciones en neonatos se realizan con la misma técnica, salvo por el tamaño de las suturas, que se reducen a polipropileno 8-0 continuo para el parche del VSD y a 7-0 para el parche del RVOT. Un PFO (foramen oval permeable) a la sonda se deja intacto, y un ASD (defecto septal auricular) más grande se cierra parcialmente.
Redmond Burke, según lo enseñado por Aldo Castaneda, John Mayer, Richard Jonas y Frank Hanley
Resultados:
Hubo un total de 394 recién nacidos, lactantes y niños a los que se les realizó la reparación de TOF durante este período. Hubo 17 pacientes con defectos de TOF y del canal AV, y 11 con TOF y ausencia de la válvula pulmonar. Hubo 2 muertes hospitalarias (supervivencia del 99.5 %). El peso promedio al momento de la cirugía de estos niños era de 6 kg (con una variación de 1.3 a 44.5 kg). Hubo 28 pacientes con <3 kg y 14 con <2.5 kg al momento de la reparación completa. Se sometió a los pacientes a la cirugía a una edad promedio de 123 días. Hubo 36 reparaciones neonatales. La estadía posoperatoria promedio fue de 6 días. El tiempo del bypass cardiopulmonar llevó en promedio 108 minutos. El tiempo del pinzamiento transversal de la aorta fue de 68 minutos.
No hubo pacientes que experimentaran bloqueo cardíaco posoperatorio y requirieran un marcapasos permanente.
| Categoría |
Cantidad de pacientes |
Edad promedio (d) |
Cantidad de muertes |
Porcentaje de mortalidad |
Mortalidad
según STS7 |
Duración de la estadía
posoperatoria
en NCH |
Duración de la estadía
posoperatoria
según STS |
| Reparación de TOF |
394 |
123 |
2 |
0.5 % |
1.2 % |
6 |
12 |
Análisis:
En mayo de 1945, Alfred Blalock y Helen Taussig informaron una serie de tres niños con enfermedad cardíaca cianótica producto de una disminución de sangre en los pulmones que manifestó una mejora clínica significativa después de que se les realizara una cirugía que creó un “ductus arterioso artificial”1. El informe fue seguido por la destacable experiencia del Dr. Blalock, quien realizó cirugías en 110 niños con patología similar. Si bien casi un cuarto de estos pacientes murió, es importante recordar que esta se trataba de una época anterior a la ecocardiografía o a la cateterización cardíaca2. La aptitud clínica para este tipo de cuidados paliativos se basaba en el grado de cianosis y en “la ausencia de pulsaciones en los hilios de los pulmones durante la evaluación fluoroscópica”.
La primera serie de pacientes a quienes se les realizó una reparación intracardíaca exitosa de TOF fue publicada por Lillehi et al. en 19553. En esta serie de diez pacientes, en principio se cerró el VSD (no había parches para VSD) y las cirugías se realizaron con circulación cruzada (esto fue antes de que hubiera una máquina de corazón-pulmón disponible).
La reparación de tetralogía como la conocemos actualmente probablemente fue descrita por primera vez en un informe por Dr. Castaneda et al. en 19654. En esta época, se creía que un niño de 4 años y con un peso de 15 kilogramos tenía la edad y el tamaño ideales para esta cirugía. La reparación primaria de TOF en lactantes fue abogada por Barratt-Boyes en 1973, cuando 25 lactantes y niños pequeños de entre 4 meses y 2 años de edad fueron sometidos a la reparación y se produjo una sola muerte5.
La reparación de TOF en neonatos es común en algunos centros hoy en día, y los resultados para estos pacientes parecen ser excelentes en las manos adecuadas6. Nuestra serie incluye a 36 pacientes a quienes se les realizó la reparación primaria de TOF en el período neonatal, sin ninguna mortalidad. Hemos descubierto que la duración de la estadía posoperatoria está inversamente relacionada con la edad a la que se realiza la reparación (figura 1), aunque la duración de la estadía posoperatoria promedio para neonatos en nuestro programa no es extremadamente larga: 9 días. Hubo 6 neonatos sintomáticos a quienes se les realizó una derivación antes de la reparación electiva. Un paciente recibió un diagnóstico de TOF y del canal AV, y los demás tuvieron anomalías coronarias que se consideraron no aptas para una reparación primaria, como una rama conal o una arteria LAD (descendente anterior izquierda) que atraviesa el RVOT.
Nuestra política actual es hacer reparaciones electivas en pacientes con TOF aproximadamente a los 4 meses de edad. La mayoría de los pacientes pueden ser tratados de forma segura y sin complicaciones si se puede realizar una reparación electiva en ese momento. Para los pacientes más pequeños que tienen síntomas como cianosis significativa o episodios de hipoxia aguda, intentaremos realizar una reparación de forma urgente en ese momento. Esto incluye a los neonatos nacidos con bajo peso y prematuros. Creemos que los cuidados paliativos en estos pacientes son una opción quirúrgica menos atractiva que una reparación completa debido a que las cirugías de derivación en pacientes más pequeños pueden provocar un mayor riesgo de obstrucción de la derivación si se usan derivaciones de menor tamaño o sobrecirculación pulmonar si se eligen derivaciones de mayor tamaño. En cualquiera de estos escenarios, los pacientes no tienen una saturación completa del oxígeno y están sujetos a un “robo” de las circulaciones sistémica y coronaria.
Para los pacientes con TOF y canal AV, nuestra política es demorar la cirugía hasta aproximadamente los 6 a 7 meses de edad, si es posible. En nuestra serie, a los pacientes con esta combinación se les realizó la reparación a una edad promedio de 175 días. A los pacientes solo con TOF se les realizó la reparación a los 120 días en promedio.
La incidencia de arritmias posopoeratorias en nuestro programa se ha informado anteriormente7. Se han dado raros casos de JET (taquicardia ectópica de la unión) posoperatoria que requirieron tratamiento médico en nuestra población de pacientes. No hay pacientes en esta serie que hayan necesitado el reemplazo de un marcapasos permanente por un bloqueo cardíaco posoperatorio.
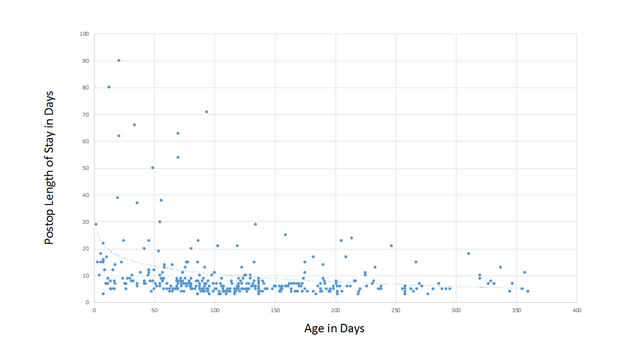
Figura 1. La duración de la estadía posoperatoria según se relaciona con la edad a la que se realiza la reparación.
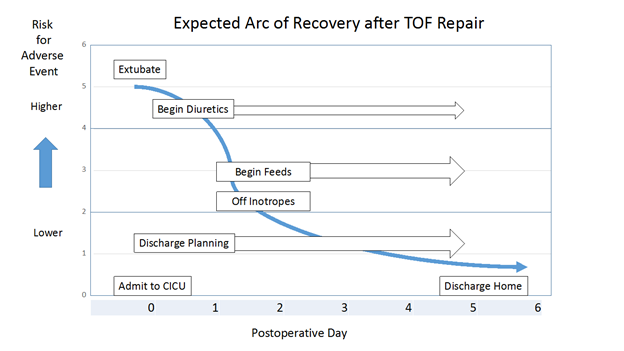
Arco de recuperación esperado:
El arco de recuperación esperado describe el tratamiento posoperatorio esperado para un paciente individual después de una cirugía congénita del corazón. Se ha descrito el arco de recuperación para pacientes a los que se les realizó una reparación de TOF y otros procedimientos quirúrgicos congénitos del corazón comunes en el manual de la CICU (Unidad de Cuidado Intensivo Cardíaco) de Nicklaus Children’s Hospital. El manual incluye protocolos de actuación clínica para los pacientes que se admiten en el programa de nuestra CICU.
Hoy en día, los pacientes a los que se les realiza la reparación electiva de TOF (salvo los recién nacidos) en nuestro programa suelen ser extubados en el quirófano. Se estima que la extubación de los pacientes que llegan a la CICU intubados se produzca en las primeras 24 horas. La mayoría de los pacientes requiere poco soporte vasopresor inotrópico o nada en absoluto, y llegan a la CICU recibiendo una infusión de milrinona, que generalmente se interrumpe en las primeras 24 a 48 horas después de la admisión. Ocasionalmente, se agrega soporte vasopresor de baja dosis en forma de infusión de epinefrina o vasopresina. Los pacientes pueden comenzar a ser alimentados el día 1 o 2 después de la cirugía. Se administran diuréticos cuando se indica clínicamente. En el momento del alta, los pacientes a menudo no requieren medicamentos cardíacos. Tal vez requieran un diurético. El alta se prevé para el día 5 o 6.
En resumen:
Presentamos los resultados de los pacientes a los que se les realizó una reparación de TOF en un solo programa durante un período superior a dos décadas. Creemos que nuestros resultados son comparables con los mejores que se han informado, con una mortalidad extremadamente baja, una duración de la estadía corta y una baja incidencia de morbilidad. Una técnica quirúrgica meticulosa puede reducir la incidencia de la mayor parte de la morbilidad posoperatoria, incluido el desarrollo de taquiarritmia o bloqueo cardíaco.
Puede ver al Dr. Burke reparando una TOF aquí: https://www.youtube.com/watch?v=lRnn1etH2tE
Puede ver al Dr. Burke reparando una TOF con AVC (canal auriculoventricular) aquí: https://www.youtube.com/watch?v=Z1JhjckgBNg
Los resultados de pacientes quirúrgicos cardíacos en Nicklaus Children’s Hospital continuaron informándose en tiempo real y esto se viene realizando desde 2001. Los Resultados en tiempo real de Nicklaus Children’s Hospital es el sitio web de informe de resultados más integral y transparente disponible hoy en día, con más de 18 años de resultados que pueden consultarse.
Referencias:
- Blalock A, Taussig HB. The surgical treatment of malformations of the heart: in which there is pulmonary stenosis or pulmonary atresia. Journal of the American Medical Association. 1945 May 19;128(3):189-202
- Blalock A. The surgical treatment of congenital pulmonic stenosis. Annals of surgery. 1946 Nov;124(5):879.
- Lillehei CW, Cohen M, Warden HE, Read RC, Aust JB, Dewall RA, Varco RL. Direct vision intracardiac surgical correction of the tetralogy of Fallot, pentalogy of Fallot, and pulmonary atresia defects: report of first ten cases. Annals of surgery. 1955 Sep;142(3):418.
- Castaneda AR, Atai M, Varco RL. Technical Considerations in the Correction of Fallot’s Tetralogy. Chest. 1965 Feb 1;47(2):223-30.
- Barratt-Boyes BG, Neutze JM. Primary repair of tetralogy of Fallot in infancy using profound hypothermia with circulatory arrest and limited cardiopulmonary bypass: a comparison with conventional two stage management. Annals of surgery. 1973 Oct;178(4):406.
- Pigula FA, Khalil PN, Mayer JE, del Nido PJ, Jonas RA. Repair of tetralogy of Fallot in neonates and young infants. Circulation. 1999 Nov 9;100(suppl_2):II-157.
- Fishberger SB, Rossi AF, Bolivar JM, Lopez L, Hannan RL, Burke RP. Congenital cardiac surgery without routine placement of wires for temporary pacing. Cardiology in the Young. 2008 Feb;18(1):96-9.
Referencias adicionales de interés:
- Taussig HB. Tetralogy of Fallot: Especially the care of the cyanotic infant and child. Pediatrics. 1948 Mar 1;1(3):307-14.
- Pacifico AD, Kirklin JW, Bargeron Jr LM. Repair of complete atrioventricular canal associated with tetralogy of Fallot or double-outlet right ventricle: report of 10 patients. The Annals of thoracic surgery. 1980 Apr 1;29(4):351-6
- Shinebourne EA, Babu-Narayan SV, Carvalho JS. Tetralogy of Fallot: from fetus to adult. Heart. 2006 Sep 1;92(9):1353-9.